 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知半电池反应:试计算
已知半电池反应:
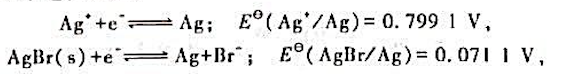
试计算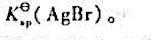
请帮忙给出正确答案和分析,谢谢!
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“已知半电池反应:试计算”相关的问题
更多“已知半电池反应:试计算”相关的问题
第3题
已知下列半电池反应及其标准电极电位为
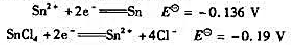
计算络合物平衡反应:
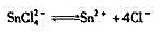 的不稳定常数。(25℃)
的不稳定常数。(25℃)
第4题
对电池Cd(Hg)(C1)ICdSO4(b)ICd(Hg)(C2).已知c1=0.0400gCd/150gHg,c2
=0.1200gCd/150gHg设活度都为1,试:
(1)写出电极反应和电池反应;
(2)计算该电池在298K时电池的电动势;
(3)计算该电池反应在298K时的ΔtGm;
(4)电池放电60.0C后重新达到平衡的电动势.
第5题
已知铅酸蓄电池
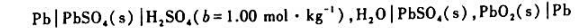
在25°C时的电动势E=1.9283V,Eθ=2.0501V.该电池的电池反应为
Pb(s)+PbO2(s)+2SO42-+4H+→2PbSO4(s)+2H2O
(1)请写出该电池的电极反应;
(2)计算该电池中硫酸溶液的活度a、平均离子活度az及平均离子活度因子γz;
(3) 已知该电池的温度系数为5.664x10-5V·K-1,计算电池反应的ΔrGm,ΔrSm,ΔrHm,
及可逆热Qr,m.
第7题
已知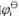 =1.51V,
=1.51V,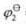 =-0.1522V,
=-0.1522V,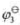 =1.3595V。若按①-❷.❷-❸.①-③方式组成电池,该如何组合?并计算各电池的电动势。
=1.3595V。若按①-❷.❷-❸.①-③方式组成电池,该如何组合?并计算各电池的电动势。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧