 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
测得电池的电动势为0.481V,计算HA的Ka。已知φSCE=0.242V。
测得电池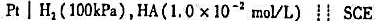 的电动势为0.481V,计算HA的Ka。已知φSCE=0.242V。
的电动势为0.481V,计算HA的Ka。已知φSCE=0.242V。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
测得电池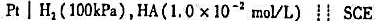 的电动势为0.481V,计算HA的Ka。已知φSCE=0.242V。
的电动势为0.481V,计算HA的Ka。已知φSCE=0.242V。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“测得电池的电动势为0.481V,计算HA的Ka。已知φSCE…”相关的问题
更多“测得电池的电动势为0.481V,计算HA的Ka。已知φSCE…”相关的问题
第1题
25℃时,下列电池的电动势为0.518V(忽略液接电位):
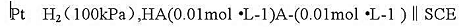
计算弱酸HA的Ka值.
第5题
已知电池PtH2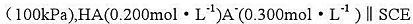 测得E=0.672V.计算弱酸HA的离解常数(忽略液接电位).
测得E=0.672V.计算弱酸HA的离解常数(忽略液接电位).
第6题
准确量取30.00ml弱酸HA,加水稀释至100ml,在下列电池中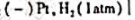
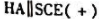 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
第7题
现有如下原电池:
 298.15K时测得电动势为0.568V,计算一元弱酸HA的标准解离常数。
298.15K时测得电动势为0.568V,计算一元弱酸HA的标准解离常数。
第8题
准确量取30.00ml弱酸,加水稀释至100ml。以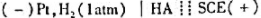 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
(1)弱酸HA的Ka。
(2)原弱酸HA的浓度。
第9题
为了测定CuY2-的稳定常数,组成下列电池:
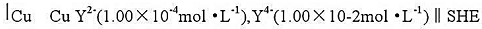
25℃时,测得电池电动势为0.227V,计算KcuY2-
第10题
测得下列电池的电动势为0.792V(25℃);
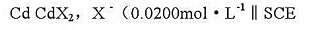
已知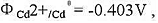 忽略液接电位,计算CdX2的Ksp.(CdX2为镉的难溶盐)
忽略液接电位,计算CdX2的Ksp.(CdX2为镉的难溶盐)


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧