 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
利用半反应和的标准电极电势(-0.065V)计算配合反映的平衡常数。
利用半反应和的标准电极电势(-0.065V)计算配合反映的平衡常数。
利用半反应 和
和 的标准电极电势(-0.065V)计算配合反映
的标准电极电势(-0.065V)计算配合反映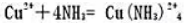 的平衡常数。
的平衡常数。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
利用半反应 和
和 的标准电极电势(-0.065V)计算配合反映
的标准电极电势(-0.065V)计算配合反映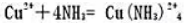 的平衡常数。
的平衡常数。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“利用半反应和的标准电极电势(-0.065V)计算配合反映的平…”相关的问题
更多“利用半反应和的标准电极电势(-0.065V)计算配合反映的平…”相关的问题
第2题
试利用标准电极电势的数据(表5.5)计算298K时反应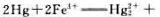
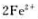 的平衡常数
的平衡常数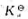 .
.
第4题
已知下列电极反应的标准电极电势:
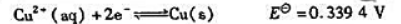
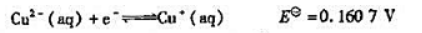
(1)计算反应: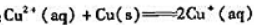 的KΘ;
的KΘ;
(2)已知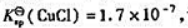 计算反应:
计算反应:
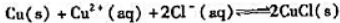 的标准平衡常数KΘ:
的标准平衡常数KΘ:
第5题
利用下列电极反应在298K时的标准电极电势:
Cu(OH)2+2e-→Cu+2OH- E1θ=-0.224V
Cu2++2e-→Cu E2θ=0.340V
求Cu(OH)2在298K时的活度积().
第7题
工业上生产水煤气的反应和相应的热力学数据如下:

计算生产水煤气的反应在标准态下自发进行的最低温度是多少?
第9题
298K时,已知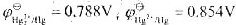 ,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧