 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
已知下列电对的Eθ:计算锰的上述两种氰合配离子的标准稳定常数的比值.
已知下列电对的Eθ:
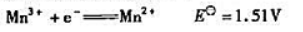
计算锰的上述两种氰合配离子的标准稳定常数的比值.
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列电对的Eθ:
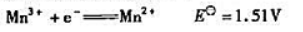
计算锰的上述两种氰合配离子的标准稳定常数的比值.
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“已知下列电对的Eθ:计算锰的上述两种氰合配离子的标准稳定常数…”相关的问题
更多“已知下列电对的Eθ:计算锰的上述两种氰合配离子的标准稳定常数…”相关的问题
第1题
,计算[AuCl2]-和[AuCl4]-的标准稳定常数.

第4题
度的影响).已知锌氨配离子的各级累积稳定常数为: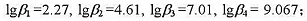 NH4+的离解常数为Ka=10-9.25.
NH4+的离解常数为Ka=10-9.25.
第6题
已知下列电对的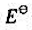 值:
值:
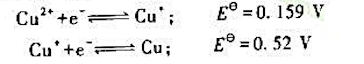
和CuCl的溶度积常数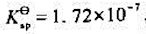 ,试计算:
,试计算:
(1)Cu+在水溶液中发生歧化反应的平衡常数:
(2)反应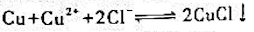 在298. 15 K时的平衡常数。
在298. 15 K时的平衡常数。
第7题
已知下列电对的标准电极电势:
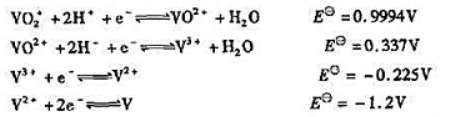
在酸性溶液中分别用1.0mol·L-1Fe2+,1.0mol·L-1Sn2+和Zn还原1.0mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?
第8题
下列电池的电动势为0.460V。计算反应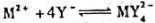 生成的配合物
生成的配合物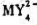 的稳定常数
的稳定常数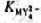 (已知
(已知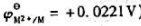 )。
)。
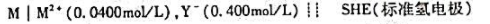
第9题
第10题
已知298.15K时,

(1)在298.15K时,把电对MnO2/Mn和CI2/CI-组成原电池,计算原电池的标准电动势;
(2)在298.15K时,计算当H+浓度为0.10mol·L-1、其他离子浓度均为1.0mol·L-1和Cl2分压为100kPa时原电池的电动势;
(3)计算298.15K时该原电池所对应的氧化还原反应的标准平衡常数。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧