 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
1molO2(g)与2molH2(g)完全反应生成2molH2O(g),反应进度ξ为().
A.0.5mol
B.1mol
C.2mol
D.无法判断
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.0.5mol
B.1mol
C.2mol
D.无法判断
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“1molO2(g)与2molH2(g)完全反应生成2molH…”相关的问题
更多“1molO2(g)与2molH2(g)完全反应生成2molH…”相关的问题
第1题
第4题
经测定,葡萄糖完全氧化反应: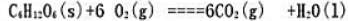 的标准摩尔反应自由能为-2840kJ.mol-1,试查出产物的标准生成自由能,计算葡萄糖的标准摩尔生成自由能。将所得数据与上题的生成焓数据做比较。
的标准摩尔反应自由能为-2840kJ.mol-1,试查出产物的标准生成自由能,计算葡萄糖的标准摩尔生成自由能。将所得数据与上题的生成焓数据做比较。
第6题
25.℃下,密闭恒容的容器中有10g固体萘(C10H8)在过量的O2中完全燃烧:
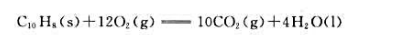
此反应过程放热401.73kJ,计算此时的反应进度及萘的完全燃烧反应的标准摩尔热力学能变和标准摩尔焓变。
第7题
A.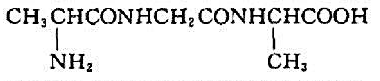
B.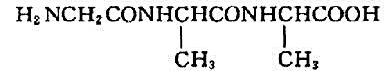
C.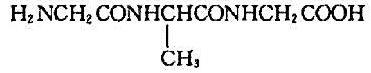
D.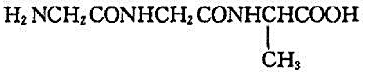
第8题
算反应进度并做出结论。
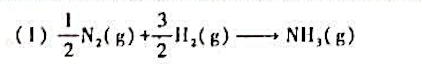
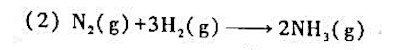
第9题
不饱和芳香烃A的分子式为C9H8,与硝酸银氨溶液反应生成白色沉淀。A催化加氢生成B(C9H12),B与高锰酸钾酸性溶液反应生成二元酸C(C8H6O4),C加热脱水生成酸酐D(C8H6O3)。试推测A,B,C和D的构造式。
第10题
CN-可用EDTA间接滴定法测定。已知一定量过量的Ni2+与CN-反应生成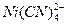 ,过量的Ni2+以EDTA标准落液滴定,
,过量的Ni2+以EDTA标准落液滴定,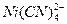 并不发生反应。取12.7mL含CN-的试液,加入25.00ml含过量Ni2+的标准溶液以形成
并不发生反应。取12.7mL含CN-的试液,加入25.00ml含过量Ni2+的标准溶液以形成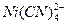 ,过量的Ni2+需与10.1mL0.0130mol·L-1EDTA完全反应。已知39.3mL 0.0130mol·L-1EDTA与上述Ni2+标准溶液30.0mL完全反应。计算含CN-试液中CN-的物质的量浓度。
,过量的Ni2+需与10.1mL0.0130mol·L-1EDTA完全反应。已知39.3mL 0.0130mol·L-1EDTA与上述Ni2+标准溶液30.0mL完全反应。计算含CN-试液中CN-的物质的量浓度。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧