 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在氨水中加入下列物质时,可使NH3的解离度和NH3溶液的pH都减小的是().
A.NH3Cl
B.NaOH
C.HCl
D.H2O
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.NH3Cl
B.NaOH
C.HCl
D.H2O
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“在氨水中加入下列物质时,可使NH3的解离度和NH3溶液的pH…”相关的问题
更多“在氨水中加入下列物质时,可使NH3的解离度和NH3溶液的pH…”相关的问题
第2题
在氨水中加入下列物质时,NH3·H2O的解离度和溶液的pH将如何变化?
(1)加NH4Cl;(2)加NaOH;(3)加HCl;(4)加水稀释。
第6题
在[Zn(NH3)4]SO4溶液中,存在下述解离平衡:

分别向溶液中加入少量HNO3溶液、氨水、K2S溶液、NaCN溶液、NaOH溶液和CuSO4溶液,上述平衡发生怎样移动?
第7题
计算下列混合溶液的pH值,已知氨水的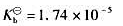
(¿21¿)20.00ml 0.200mol/LNH3水溶液加入10.00ml 0.200mol/LHCI溶液;
(2)20.00ml 0.200mol/LNH3水溶液加入20.00ml 0.200mol/LHCI溶液;
(3)20.00ml 0.200mol/I,NH3水溶液加入30.00ml 0.200mol/LHCI溶液。
第9题
往含有0.1mol/L的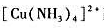 配离子溶液中,加入氨水,使溶液中NH3浓度为1.0mol/L,请计算达到平衡时溶液中Cu2+离子浓度为多少?已知
配离子溶液中,加入氨水,使溶液中NH3浓度为1.0mol/L,请计算达到平衡时溶液中Cu2+离子浓度为多少?已知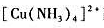 的
的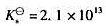
第10题
已知M(NH3)42+的 为2.0、5.0、7.0、10.0; M(OH)42+的
为2.0、5.0、7.0、10.0; M(OH)42+的 为4.0、8.0、 14.0、15.0.在浓度为0.10 mol.L-1的M2+溶液中,滴加氨水至溶液中的游离NH3度为0.010mol.L-1, pH=9.0.试问溶液中的主要存在形式是哪一种? 浓度为多大?若将M2+溶液用NaOH和氨水调节至pH=13.0且游离NH3浓度为0.010mol.L-1则上述溶液中的主要存在形式是什么?浓度又为多少?
为4.0、8.0、 14.0、15.0.在浓度为0.10 mol.L-1的M2+溶液中,滴加氨水至溶液中的游离NH3度为0.010mol.L-1, pH=9.0.试问溶液中的主要存在形式是哪一种? 浓度为多大?若将M2+溶液用NaOH和氨水调节至pH=13.0且游离NH3浓度为0.010mol.L-1则上述溶液中的主要存在形式是什么?浓度又为多少?


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧