 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
利用的K=1014和Ag2CrO4的溶度积以及Ag++e-=Ag的标准电极电势求2Ag2
利用 的K=1014和Ag2CrO4的溶度积以及Ag++e-=Ag的标准电极电势求2Ag2CrO4+2H+-4e-=4Ag++Cr2O72-+H2O的标准电极电势。
的K=1014和Ag2CrO4的溶度积以及Ag++e-=Ag的标准电极电势求2Ag2CrO4+2H+-4e-=4Ag++Cr2O72-+H2O的标准电极电势。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
利用 的K=1014和Ag2CrO4的溶度积以及Ag++e-=Ag的标准电极电势求2Ag2CrO4+2H+-4e-=4Ag++Cr2O72-+H2O的标准电极电势。
的K=1014和Ag2CrO4的溶度积以及Ag++e-=Ag的标准电极电势求2Ag2CrO4+2H+-4e-=4Ag++Cr2O72-+H2O的标准电极电势。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“利用的K=1014和Ag2CrO4的溶度积以及Ag++e-=…”相关的问题
更多“利用的K=1014和Ag2CrO4的溶度积以及Ag++e-=…”相关的问题
第5题
A.AgCl和Ag2CrO4的溶解度可由两者溶度积求得
B.AgCl和Ag2CrO4两者类型不同,不能用溶度积直接比较溶解度大小
C.AgCl溶解度大于Ag2CrO4
D.AgCl和Ag2CrO4都是难溶盐
E.AgCl和Ag2CrO4两者的IP大于各自溶度积时开始沉淀
F.向有[Cl-]、[CrO42-]存在的溶液中逐滴加硝酸银溶液,AgCl先出现
第6题
利用下列电极反应在298K时的标准电极电势:
Cu(OH)2+2e-→Cu+2OH- E1θ=-0.224V
Cu2++2e-→Cu E2θ=0.340V
求Cu(OH)2在298K时的活度积().
第7题
第9题
已知25°C时AgBr的溶度积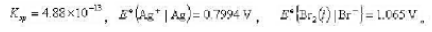 试计算25°C时
试计算25°C时
(1)银-溴化银电极的标准电极电势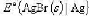 ;
;
(2)AgBr(s)的标准生成吉布斯函数。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧