 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
对于二级反应以()对()作图得一条直线;反应的半衰期与反应物起始浓度的定量关系为().
对于二级反应以()对()作图得一条直线;反应的半衰期与反应物起始浓度的定量关系为().
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“对于二级反应以()对()作图得一条直线;反应的半衰期与反应物…”相关的问题
更多“对于二级反应以()对()作图得一条直线;反应的半衰期与反应物…”相关的问题
第2题
A、反应速率与反应物A的浓度成正比
B、以一对:作图得一直线
C、反应的半衰期与反应物A的起始浓度成反比
D、反应速率系数的常用单位是L·mol-1·s-1
第3题
A、
B、
C、
D、
第4题
对基元反应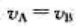 反应物A的消耗速率vA与反应物B的消耗速率vB的关系为()
反应物A的消耗速率vA与反应物B的消耗速率vB的关系为()
A、
B、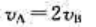
C、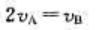
D、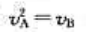
第5题
某基元反应A→B+c的半衰期为t1/2=10h.经30h后的反应物浓度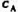 与初始浓度
与初始浓度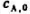 .的比值为().
.的比值为().
第6题
在T,p及组成一定的条件下,反应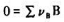 的
的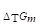 与反应进行
与反应进行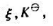
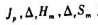 及化学势μs之间的定量关系为
及化学势μs之间的定量关系为
ΔtGm=()=()=()=()
第7题
在等温条件下,对于气体反应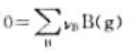 反应的摩尔焓变与摩尔热力学能变之间的关系为()。
反应的摩尔焓变与摩尔热力学能变之间的关系为()。
第8题
蔗糖水解反应
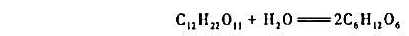
活化能Ea=110kJ·mol-1;298K是其半衰期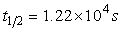 ,且
,且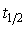 与反应物浓度无关。
与反应物浓度无关。
(1)求此反应的反应级数;
(2)写出气速率方程;
(3)求308K时的速率常数k。
第9题
可逆反应的标准摩尔吉布斯自由能变与反应的标准平衡常数之间的定量关系为();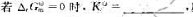 反应在标准状态下()。
反应在标准状态下()。
第10题


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧