 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
将H2S气体通入ZnSO4 溶液中, ZnS沉淀很不完全。但如果在ZnSO4溶液中先加人NaAc, 再通入H2S气体, ZnS沉淀几乎完全。试解释其原因。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“将H2S气体通入ZnSO4 溶液中, ZnS沉淀很不完全。但…”相关的问题
更多“将H2S气体通入ZnSO4 溶液中, ZnS沉淀很不完全。但…”相关的问题
第1题
试用溶度积规则解释下列事实:
(1) CaCO3溶于稀HCI中:
(2) Mg(OH)2溶于NH4CI溶液中;
(3)AgCl溶于氨水,加人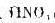 后沉淀义出现;
后沉淀义出现;
(4)往ZnSO4溶液中通人H2S气体,ZnS往往沉淀不完全,甚至不沉淀,但若往ZnSO4浴液中先加人适量的NaOAc,再通人H2S气体,ZnS几乎完全沉淀。
第3题
A.A.0.51
B.B.0.45
C.C.0.15
D.D.0.13
第4题
A.0.51
B.0.45
C.0.15
D.0.13
第7题
解释实验现象:
(1)将CO气体通入二氯化钯溶液中,溶液变黑。
(2)将甲硅烷通入KMnO4溶液中,溶液褪色,有棕黑色沉淀和气泡产生。
(3)将CO2气体通入澄清的石灰水中,溶液变浑浊,继续通入至过量后,溶液又变澄清。
(4)Al4C3和水作用有白色沉淀和气体生成。
(5)向SnCl4溶液中滴加Na2S溶液,有沉淀生成,继续加入沉淀又溶解,再以稀盐酸处理此溶液,又析出沉淀。
(6)向氯化汞溶液中滴加SnCl2溶液,先生成白色沉淀,随着SnCl2溶液滴入至过量,沉淀逐渐变灰、变黑。
(7)向Pb(NO3)2溶液中滴加K2CrO4的中性或弱碱性溶液,生成黄色沉淀;而向Pb(NO3)2溶液中滴加K2CrO4的酸性或强碱性溶液,则无沉淀生成。
第8题
g)使之成为H2S饱和溶液,并加HCl控制S2-浓度.为了使PbS沉淀出米,而Zn2+仍留在溶液中,则溶液的H+浓度最低应是多少?此时溶液中的Pb2+是否被沉旋完全?
第9题
把H2S和SO2气体同时通入Na0H溶液中至溶液呈中型,有何结果?
(2)写出以S为原料制备以下各种化合物的反应方程式,H2S、H2S2、SF6,SO3,H2SO4、SO2Cl2、Na2S2O4。
第10题
已知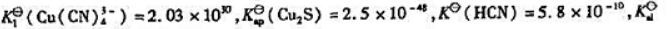
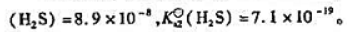
向[Cu(CN)4]3-溶液中通入H2S至饱和,写出反应方程式,计算其标准平衡常数,说明能否生成Cu2S沉淀.


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧