题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
电池Pt(s)|H2(pθ)|KOH(0.lmol·kg-1)|HgO)(s)|Hg(I)在25℃时的电动势为0.926V.
请:
(1)写出电极反应和电池反应;
(2)计算电池的标准电动势和ΔtGmθ;
(3)在25℃及100kPa下,求能否被空气中的水燕气转化为氧化汞和氢气?
在25℃,100kPa下相变:H2O(l)=H2O(g)的ΔtGmθ(298K)=8.59kJ·mol-1,设空气中水燕气和氢的摩尔百分敷分别为1.1%和0.01%.
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案


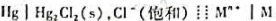 。在25℃时,测得电动势为0.100V,如将Mn+浓度稀释50倍,测得电池电动势为0.050V,此时金属离子的电荷数n是多少?
。在25℃时,测得电动势为0.100V,如将Mn+浓度稀释50倍,测得电池电动势为0.050V,此时金属离子的电荷数n是多少?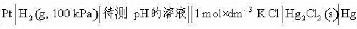 在25°C时测得电池电动势E=0.664V,试计算待测溶液的pH。
在25°C时测得电池电动势E=0.664V,试计算待测溶液的pH。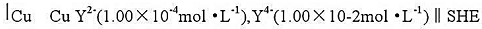
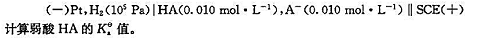
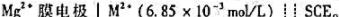 。在25℃时,测得电动势为0.387V。
。在25℃时,测得电动势为0.387V。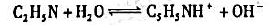
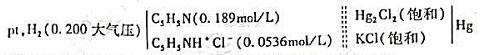
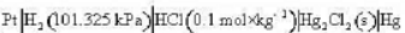 电动势召与温度T的关系为
电动势召与温度T的关系为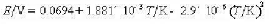
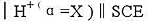 当缓冲溶液由未知溶液代替时,测得电池电动势如下:
当缓冲溶液由未知溶液代替时,测得电池电动势如下: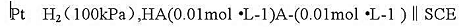
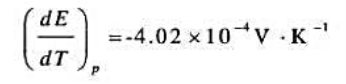
 ;
; ;
;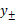 。
。